重组人血白蛋白商业化之路道阻且长
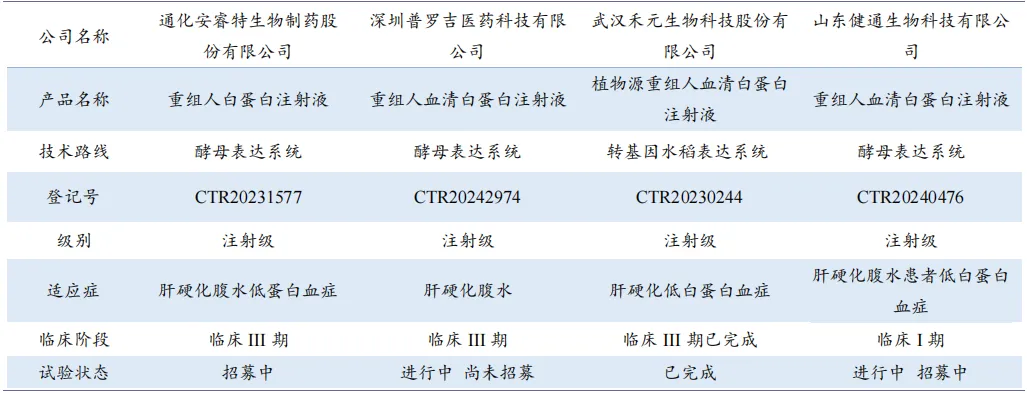
重组人血白蛋白(rHSA)作为人血白蛋白的替代产品,国内外开展相关研究已数十年,目前仍未出现在全球大范围内上市的成熟产品。截至2024年10月末,国内进入临床试验阶段的rHSA注射剂共四项。商业化进度方面,①通化安睿特于2023年5月开展国内临床III 期试验,2023年完成重组人白蛋白生产基地一期工程建设,2024年4月8日,产品在俄罗斯的获批上市,包括5%、10%、20%三个浓度;②深圳普罗吉医药于 2023年4月展临床 III 期试验,2022年启动一期产业园建设;③禾元生物HY1001于2023年12月完成临床III 期试验,上市申请已受理并纳入优先审评名单,公司预计于2025年第三季度获批上市;④健通生物的产品仍在临床 I 期进行中。
重组人血白蛋白在国内实现大规模商业化之路道阻且长,基于:
-
技术和工艺方面:由于白蛋白的广谱性结合能力,能结合许多内源性和外源性物质(脂肪酸、胆红素、乙酰胆碱、药物、染料及金属离子等),其在发酵、植物合成过程中极易结合未知杂质,因此在纯化过程中不仅要去除表达环境中有关杂质,还需取出白蛋白结合和聚合的杂质。如何低成本地获得高质量高纯度的重组人血白蛋白,并且保证生产工艺的稳定,仍需要后续的验证。
-
临床适应症方面:目前全球在研的rHSA产品基本均以肝硬化相关并发症为适应症,而肝脏疾病在白蛋白临床使用比例不到10%。因此在推广重组人血白蛋白过程中,拓展适应症范围是无法避免的关键阻碍。据禾元生物招股书,公司未来将在严重烧伤、重症脓毒血症、恶性肿瘤恶病质等适应症上拓展研究。然而对于这些完全不同病理的适应症,其病理过程、治疗规范、疗效终点、受试人群等无法做到与肝硬化有效接轨,将大大增加临床试验难度和实现时间。
-
产品审批及推广方面:截至2024年9月末,尚未有 rHSA产品在FDA或EMA获批,其临床使用效果还未得到任何组织及指南的认证,因此rHSA产品在NMPA注册审批时可能会由于缺乏权威参照,而面临一定程度的困难。rHSA产品还存在获得医生和患者认可的风险。